fisicoquímica
Marilu R.
OBJETIVO:
Es generar más procedimientos y ejemplos de algunos temas que tienen que ver con el aprendizaje de la materia de fisicoquímica mostrando paso por paso la solución de un problema o de igual manera mostrando información más específica e importante de un tema, de esta manera para poder facilitar el conocimiento en el que uno está interesado
Cuando hablamos de fisicoquímica
nos resulta algo complicado, decidimos no pedir información, o ignorarla completamente
y más si una persona no tiene un interés por ella y solo pide información por
que podría ser para el acceso de aprobar una simple materia, algunos aún se preguntarían
cual sería el propósito de ella o como lo llevamos a cabo en la vida o simplemente
no se tiene uno ni la mínima idea con lo que tenga que ver, o podría ver personas
que si les interesaría pero se encuentran dudas de cómo darle solución a un
problema y es ahí donde uno pone de su parte para resolver algunas dudas pero ahora empezare por decir que la fisicoquímica
si tiene que ver y esta presente en la vida cotidiana ya que controla y predice
los procesos químicos para su utilización, te lleva a dar una medida exacta
para comprender el efecto, en la siguiente información encontraras algunos tipos
de resolución de problemas para su mejor
entendimiento además de que muestra información clara y especifica.
TRABAJOS:
TERMOQUÍMICA Y TERMODINÁMICA
La Termoquímica:
estudia las cantidades de calor que acompañan a las reacciones químicas.
Termodinámica:
ciencia que estudia el movimiento del flujo del calor
REACCIONES EXOTÉRMICAS Y SU RELACIÓN CON EL CAMBO CLIMÁTICO
Una reacción
endotérmica es una reacción química que para que sucedan se les aplica calor sin
en cambio una reacción exotérmica es una reacción química donde se desprende el
calor.
Un ejemplo de
su relación con el cambio climático:
cambio climático
↙ ↘
exotérmica endotérmica
↓ ↓
combustión incrementación
↓ de
quema de cualquier temperatura
sustancia ↓
↓ calentamiento
desprende calor en la tierra
↓ ↓
ocasiona ocasionan
↓ ↓
efecto invernadero polos derretidos
y deshielo
El calor especifico es la capacidad de energía térmica en
cualquier sustancia excepto el agua
formula:
Q
Ce= ⏤⏤⏤⏤
m ∆TCe= ⏤⏤⏤⏤
Donde:
Q= Calor ( cal)
m= masa en (kg)
Ce=calor especifico en (cal/g
ºC )
∆T(T2-T1)= variación de temperatura en ( ºC)
1.-Calcular el Ce de cierta
sustancia de la que se sabe que tiene una masa de 20.3 kg a la que se le aplica
un calor de 1553.36 kj para que su temperatura se a de 21.3 a 24.5 ºc
1553360 j
1kj=1000j
Ce=——————
Ce=——————
20300g (24.5 - 21.3ºc) 1kg =1000g
——————
64960 kg ºc
Ce=23.9 j/g ºc
2.El Ce del Al es de 0.896 j/ gºc ¿Qué cantidad de calor se requiere para calentar 120.25 g de Al a una temperatura de 20.7 a 35.4 ºF?
ºF a ºC
Q= Ce m( ∆T) ºC= ————
1.8
Q=(0.896J)(120.25g ) [(1.8ºc) -(-6.27ºc)]
Q= (0.896J) (120.25g)
(8.15ºc)
Q=(0.896J/gºc)(980.0375gºc)
Q= 878.113600 J
3.-¿cuántas calorías son necesarias para calentar 350ml de
agua para preparar café. Si se calienta el agua de 15.2 a 79.5ºc’
formulas: Q= Ce m( ΔT) 1 cal=
4.184j 1J =.239 cal
Q=(4.189j/gºc) (350g) (79.5ºc -15.2ºc)
Q=(4.184 j)(350)(64.3)
Q=(4.184 j) (22505)
Q=94160.920 J
Conversión:
Conversión:
Q=(94160.920)(.239)
Q= 22504.459880 cal
Entalpía
Es el contenido calórico que tiene determinada sustancia en
un sistema cerrado
Hº=∑ Hº productos- ∑Hº reactivos
(Entalpía de reacciones es igual a la sumatoria de Entalpía
de productos menos la sumatoria de reactivos)
1.-Calcular la entalpia de la siguiente reacción química.
2 Co + O2 ➝ 3Co2
Anhídrido carbónico = (- 110.5 Kj/mol)
Oxigeno= (0 kj/mol)
Anhídrido carbonoso =(-374.5 Kj/mol
Hº=[(2)(-110.5Kj/mol)] - [(2)(-374.5)+(0 kj/mol)]
Hº=(-221 kj/mol)-(-749 kj/mol)
Hº= -221 +749
Hº= 528 Kj/mol La reacción es Endotermica
2.-En la combustión del gas octano se libera una energía de
-1,112.48 KJ.
a) calcular el calor que se libera en la combustión de
50.5g de gas octano
formula 2C8H18 + 25O2 → 16CO2 + 18H2 O
Gas octano
Masa atómica del (C)
12.011
Masa atómica del (H) 1.0079
M.A (C) 12.011x8 =96.088
M.A (H) 1.0079x18 =18.1422
suma: 96.088
+18.1422 = 114.2302 g/mol
Conversión:
1Mol → 114.23g
1Mol → 114.23g
x → 50g
50 ÷114.23 = .44 mol
Conversión:
2 Mol oct. → -1,112.48 Kj
2 Mol oct. → -1,112.48 Kj
.442 Mol → x
-1,112.48 Kj x .44 Mol = 489.4912
489.4912 ÷ 2 =
- 244.7456 Kj
la reacción es exotérmica es exotérmica
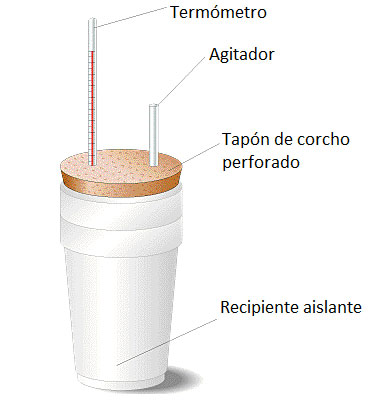
CALORÍMETRO
Es un instrumento que sirve
para medir las cantidades de calor
CALORÍMETRO
Es un instrumento que sirve para medir las cantidades de calor.
materiales:
Lata porta penetron de 20 cm de diámetro y 22 de alto
Espuma expansiva sika
termómetro
agitador
Espuma
clavo
cuter
agua
hidróxido de sodio
procedimiento:
 https://feria-ciencias-elvis.blogspot.com/2014/12/calorimetro-adiabatico-casero.html?fbclid=IwAR2-JEos_X7A3r3MGHT_egiskiKiXYoiMdsHtvj7IZCLYsreT4icA7JPYmg
https://feria-ciencias-elvis.blogspot.com/2014/12/calorimetro-adiabatico-casero.html?fbclid=IwAR2-JEos_X7A3r3MGHT_egiskiKiXYoiMdsHtvj7IZCLYsreT4icA7JPYmg
procedimiento:
 https://feria-ciencias-elvis.blogspot.com/2014/12/calorimetro-adiabatico-casero.html?fbclid=IwAR2-JEos_X7A3r3MGHT_egiskiKiXYoiMdsHtvj7IZCLYsreT4icA7JPYmg
https://feria-ciencias-elvis.blogspot.com/2014/12/calorimetro-adiabatico-casero.html?fbclid=IwAR2-JEos_X7A3r3MGHT_egiskiKiXYoiMdsHtvj7IZCLYsreT4icA7JPYmg
Se tiene una temperatura
inicial de Agua de 16ºc con una masa de 6 gramos de hidróxido de sodio que se le agrego 100 ml de
agua sabiendo que el calor especifico de hidróxido de sodio es .35cal/g y su temperatura final fue de 32ºc ¿Qué
cantidad de calor se aplicó?
Q= Ce m (∆T)
Q= 0.35 cal/gºc (6g) (32ºc-16ºc)
Q=.35 cal/ºc (6) (16ºc)
Q=.35 cal/ºc (96ºc)
Q=33.60 cal se
libero de calor
ENTROPÍA
La entropía es la magnitud
termodinámica que indica el grado de desorden molecular en un sistema.
∆Sº =∑Sº productos -∑Sº reactivos
[Δsº ]=J/ºk
Calcula la entropía de la siguiente reaccion
pasos
1) escribir
ecuación
2) balancear
ecuación
3) calcular
la variación de entropía
cobre +oxigeno → oxido cúprico
Cu +O
Cu2O2
2Cu + O2 2Cu O
ΔSº=2(408.5 J/ºK)- [2 (395.8 J/ºK)+455.7K/º]
ΔSº= 817 J/ºK - 791.6J/ºK + 455.7J/ºK
ΔSº= 817J/ºK - 1247.3
J/ºK
Δº= -403.3 J/ºK
Te recomiendo ver el siguiente vídeo para un mejor
entendimiento.
ENERGÍA LIBRE DE GIBBS
Es la energía necesaria para producir un trabajo a
temperatura y a presión constantes.
ΔGº= Hº - TSº
(Energía libre de Gibbs es igual a la entalpia menos la
temperatura por entropía)
acido + hidrixido de → plurufato de + oxido de
perflurico aluminio aluminio dihidrogeno
3HFO4 + Al(OH)3 → Al(FO4)3 十 3H2O
ΔHº=
335.52 J/mol 625.3J/mol 228.5 J/mol 124.5 J/mol
Δsº= 238.7kj/ºk 430.8kj/ºk 183.5kj/ºk 339.7kj/ºk
T =19 ºC ºC
a ºk
Hº= [(228.5 j/mol) + 3(124.5 j/mol)] – [3(335.52 j/mol) +
(625.35 j/mol)]
Hº=(228.5j/mol +373.5 j/mol) -
(1006.56j/mol + 625.35 j/mol)
Hº=602 J/mol -
1631.81 j/mol
Hº= -1029.8 j/mol
ºK = ºC +273.15
ºK= 19+273.15
ºK= 292.15
ΔSº=Sº productos - sºreactivos
Δsº=[(183.5 kj/ºk) + 3(339.7kj/ºk)] - [3(238.7 kj/ºk)+ (430.8kj/ºk)
Δsº= (183.5 kj/ºk +1019.1 kj/ºk ) - (716.1
kj/ºk + 430.8kj/ºk)
Δsº=1202.6 kj/ºk -
1146.9 kj/ºk
Δsº= 55.7 kj/mol x 1,000
Δsº=55,700 j/mol
ΔGº= H – T Sº
ΔGº= - 1029.8 j/mol - (292.15ºk)(55700 j/mol)
ΔGº= -
1029.8 j/mol -16272755 j/ºkmol
ΔGº= -16,273,784.8 J/mol ºk
CONSTANTE DE EQUILIBRIO
formula:
Es una medida característica de cada reacción bajo
condiciones de temperatura y presión especificas constantes.
Acido Hidróxido de Fosfito de Oxido de
fosforoso magnesio magnesio
dihidrógeno
2H3PO3 +
3Mg(OH)2 → Mg3(PO)2 + 6H2O
.003M 0.012M 0.009M 0.001M
[0.009m] [0.001m]⁶
[0.009m] [0.001m]⁶
Keq= –––––––––––––––
[0.003m]² [0.012m]³
[0.9x10ᐨ³m] [0.1x10ᐨ¹⁸m]
keq= ––––––––––––––––––––
[0.9x10ᐨ⁶m] [1.728x10ᐨ⁷]
[0.9x10ᐨ²¹m]
keq= ––––––––––––
[1.5552x10ᐨ¹¹]
keq= 5.78x10ᐨ¹⁰
pH Y POH
1-Se tiene una solución
de Ácido bórico con una concentración de 0.315m suponiendo que el Ácido bórico
se ioniza al 100%cual será el pH y el POH de la solución.
H₃BO₃
pH= -log [H+] formula
pH=-log [(0.315)(3)]
pH= -log [0.945]
pH=0.0245
POH =14 – pH formula
POH =14 - 0.0245
POH= 13.975
CONCENTRACIÓN
A continuación, te
recomiendo ver el siguiente vídeo para que pueda ser mejor entendible.
2.-Se tiene una solución de cierta sustancia de la que se sabe que su pH= 0.80m
a) calcular la [H+]
b) calcular el POH
c)calcular la [OH]
pH=80m
POH= 14 – pH
POH=14- 0.80
POH= 13.2
[Hᐩ] = 10ᐨᴾᴴ
[Hᐩ]= 10ᐨ⋅⁸⁰
[Hᐩ]=0.158M
[OHᐨ]= 10ᐨᴾᴼᴴ
[OHᐨ]=10ᐨ¹³⋅²
[OHᐨ]=6.30X10ᐨ¹⁴m
"pH FISIOLÓGICO Y LAS FUNCIONES BÁSICAS DEL CUERPO HUMANO"
Sin duda muchas de las personas
ignoramos la manera en cómo nos cuidamos, en querer conocernos otro poco más
allá de nuestro interior, y aun así a
pesar de la información que recibimos alrededor no lo hacemos , probablemente
solo personas estudiadas se dan cuenta de aquello pero estoy segura de que
todavía algunos se preguntan aun ¿cuál sería la importancia de hacerlo? pues
aquí hablare de un tema en particular de que es el pH sabiendo que el ph
es fundamental y que puede darse en
distintas áreas de conocimiento pero en este caso yo me enfocare en la
nutrición ya que el saber alimentarnos bien nos lleva a una buena salud pero
cuando no lo hacemos corremos muchos riesgos y que para esto debemos de conocer muy bien cómo va
influyendo. Entonces el no tener nuestro pH en equilibrio nos lleva a consecuencias
como lo he dicho anteriormente, y somos
dichos de provocarnos nuestros propios daños cada día y que sin darnos cuenta
nos puede llevar a algo tan grave como
la muerte, a veces por seguir probando alimentos el cual se nos hace una
delicia, y que lamentablemente la mayoría de estos son ácidos, además de que
daña a algunos órganos importantes, y que nos genera una Acidosis dentro de nuestro
organismo, entonces ¿ahora vemos la grande importancia que tiene el saber balancear
nuestros alimentos?, a continuación conoceremos más sobre cuáles son los
alimentos más peligrosos y que es lo que debemos de evitar frecuentemente y cómo influye poco a poco en nuestro organismo
cuando no lo hacemos.
desarrollo
El pH fisiológico es un nivel de concentración de acidez o
alcalinidad de dicha sustancia y que va
a determinar el estado de salud del cuerpo ,una persona puede considerarse que
esta bien en un estado de salud cuando no tiene problemas en su organismo, es
decir alguna enfermedad o que tenga problemas con un consumo excesivo de
alimentos que se consideran con mucho acido, nuestro pH se va a enfocar a medir
el grado de acidez que nosotros le acumulemos a nuestro estomago mediante los
alimentos
“la escala del pH varia del 0
al 14, de forma que se considera 7 como un valor de pH neutro, menos de 7 se
vuelve más acido, arriba de 7 se vuelve más alcalino” (Estado, 2018)
es decir aquí tenemos una
referencia exactamente cómo vamos lo vamos a poder identificar cuando una
persona estará anivelada, correrá mayor riesgo cuando puede ser que se
encuentre por el grado de acidez menor
que siete y ligeramente una persona estará sana cuando su pH este en el grado
neutro y un poquito elevado al alcalino.
“El cuerpo simplemente no
puede tolerar los desequilibrios hacia un estado de acidez prolongado” (Replied,
2014)
a mi parecer se ha notado que
las personas por no cuidar la alimentación que ingieren empiezan a tener
problemas y por ello es una causa de la cual accedan a los hospitales y
estoy favor de lo dicho anteriormente ya
que mediante la regla del pH el cuerpo no podrá tolerar tanta acidez lo que nos
ocasionara algún efecto en el organismo que pueda ser que el sistema se debilite,
y si la persona no se cuida aun prácticamente será mayor el riesgo que le ocasionaremos
a nuestra salud además de quemar nuestra laringe que no es tan resistente para
soportar los ácidos, y que pueda ser imposible ser curado, según el doctor
Alberto Martí Bosh los alimentos que provocan acidez son: los Productos lácteos,
Carnes, Todas las formas de azúcar, Vinagre ,Alimentos procesados y con
aditivos, huevos, Café y Alcohol.
“El exceso de acidificación
del cuerpo es la causa de todas las enfermedades degenerativas. Si ocurre una
perturbación del equilibrio un cuerpo comenzara a producir y almacenar más
acidez y residuos toxicas que provocara que las enfermedades empiecen a
manifestarse” (Rolando, 2016)
Puedo decir que estaría a
favor porque sin embargo además de los daños dentro de el organismo ocurre que
la mayor enfermedad que se da en la sociedad es la diabetes y que abemos que es
provocada a acusa de el exceso de azucares y grasas que se digieren además
puede darse en distintas personas a veces porque se llega a heredar así que no
debemos de pensar que nada nos hará daño por que para vivir en un perfecto
estado debemos de balancear nuestra alimentación .
“para que nuestra sangre pueda
cumplir con las funciones de que las células se alimenten y puedan eliminar
residuos y poder renovarse todo el tiempo debe de mantenerse en un bance de
7.35 y7.45 ligeramente alcalino” (Marina, 2012)
A mi parecer la sangre es esencial
y juega un papel muy importante en nuestro cuerpo y que también ocasiona
enfermedades que te pueden ocasionar la muerte además es fundamental para un
buen funcionamiento del cuerpo ya que se encuentra lleno de aquello por lo
tanto por eso debemos de mantenerlo en estado alcalino con ayuda de alimentos
sanos que el doctor Alberto Martí Bosh dice que son como las frutas, el agua,
las Verduras verdes, Cereales integrales y la Miel.
“En las primeras etapas de
este desequilibrio los síntomas pueden incluir cosas tales como erupciones en
la piel dolores de cabeza alergias resfriados gripe ya en etapas mayores las
enfermedades se vuelven más graves o suele dañarse algún órgano dentro del organismo”
· (Replied, 2014)
puedo estar en acuerdo por que
lo podemos ver a simple vista y suele pasarle a las personas cuando se consume
muchos ácidos y después de un tiempo hay problemas constantemente y es ahí
donde uno tiene razón de que pueden llegar a tener daños en tu estado de salud
y por el contrario prácticamente si se ha avanzado el problema que sea difícil
de ser curado ,nadie quiere verse enfermo o provocarse una muerte por una causa
que pudo ser evitada.
conclusión
puedo concluir con lo dicho
anteriormente que es muy importante el saber cómo influye el pH con la
alimentación en la manera de cómo nos
alimentamos, que es lo que consumimos y probablemente si lo que han
comido con mayor frecuencia han sido los alimentos ácidos, dejar de consumir lo
mas que se pueda y comenzar una nueva dieta con las verduras, para que nuestra
sangre siga cumpliendo las funciones de eliminar dichos residuos y pueda
mantenerse neutralizado por que el exceso de acidificación es una de las
principales causas de muchas enfermedades y que se va dando mediante el consumo
de dichos alimentos con mayor acidez y que se consumen constantemente además de
como influye en nuestro organismo y que enfermedades nos pueden llegar a
provocar y cómo podemos evitarlo ya que
lo más importante de todo es nuestra salud.
Bibliografía
Estado, I. d. (13 de julio de 2018). gob.mx.
Obtenido de gob.mx:
https://www.gob.mx/issste/articulos/el-equilibrio-del-ph-en-el-organismo?idiom=es
Replied, R. (8 de
septiembre de 2014). SaludBio. Obtenido de https://saludbio.com/articulo/el-pH-y-la-salud
Rolando, C. (25 de
abril de 2016). ROCHADE: ECONOMÍA, ACTUALIDAD Y MEDICINA NATURAL.
Obtenido de
http://www.rochade.cl/la-acidez-del-organismo-efectos-la-salud-especialmente-cancer/
¿cuál fue el mejor trabajo que
realizaste en este semestre?
El mejor trabajo que realice en este semestre fueron los cálculos de entropía ya que al resolver los problemas mediante los pasos ya tenía una idea clara de cómo sería el proceso, además de que mis resultados fueron los correctos y se me facilito analizar en mi respuesta cuando había un aumento o no de entropía además de que también este nos sirve para conocer cuál es la energía útil utilizada en un trabajo.
El mejor trabajo que realice en este semestre fueron los cálculos de entropía ya que al resolver los problemas mediante los pasos ya tenía una idea clara de cómo sería el proceso, además de que mis resultados fueron los correctos y se me facilito analizar en mi respuesta cuando había un aumento o no de entropía además de que también este nos sirve para conocer cuál es la energía útil utilizada en un trabajo.
¿Cuál fue el peor trabajo?
Sin embargo, el peor trabajo fue
la elaboración del calorímetro, porque se tardó en hacerlo, no hubo una organización
adecuada, además de que en el momento de hacer el experimento fue de una manera
rápida y no se logro ver claramente el proceso así que no me pareció muy
interesante pero finalmente si logramos el objetivo.
¿Cuál es el tema que te parecido
más importante?
El tema que me pareció más importante
fue el ensayo que tuvo que ver con el pH y las funciones básicas del cuerpo
humano que se basó en la nutrición ya
que es una realidad que nosotros hacemos a diario, que mucha gente ignora teniendo
información tan cerca, si las personas tienen enfermedades ha sido por
ignorancia porque no es difícil el poder cuidarse aun consumiendo esos
alimentos, en lo personal cuando me puse investigar me di cuenta que pertenecía
a una de esas personas ignorantes hubo mucha información que conocía pero
ignoraba sus consecuencias ahora que lo sé tratare de evitarlo.
¿Cuál es el tema que te pareció
menos importante?
El tema que me pareció menos
importante fueron las reacciones Exotérmicas y Endotérmicas y la relación con
el medio ambiente simplemente porque a pesar de que uno quiera que evitemos
esas causas que ocasionan que el clima empeore la mayoría de las personas en el
mundo no entenderá al contrario vamos empeorando cada vez. Y más con la contaminación
que hasta los países mas desarrollados son lo que más lo ocasionan.
¿Cómo aplicas personalmente en
tu vida los conocimientos adquiridos en este curso?
Yo que creo que siempre se
aplica la fisicoquímica en la vida de una u otra forma pero ahora mis conocimientos
los aplicaría en la manera que cocinaría, al agregarle un tiempo determinado a
la estufa, al saber que desde que nos movemos ocasionamos un tipo energía, en
los alimentos que consumimos y tener en cuenta todo lo que ocasiona, seria un
poco cuidadosa ahora que sé que todo debe de tener una medición.
Conclusión
A mi parecer en esta materia me
parecieron unos temas importantes además de que tuve un buen conocimiento en
temas específicos ya que me ayudaron a darme un conocimiento más a fondo de lo
que parecía y que a pesar también los
llevamos a cabo en la vida cotidiana, pero también lleve a cabo temas que no comprendí
exactamente y que debería de mejorar en ese aspecto, ser mas exigente en mi
misma, porque todo lo que me enseñaron
siempre será visto en la vida cotidiana y solo podrán ser observados y darles
un resultado aquellos que tengan más conocimiento.
Bibliografía
FELIU Y PÉREZ, B. (2004). Aparatos para la enseñanza
de las leyes físicas del siglo. Obtenido de
https://www.upct.es/seeu/_as/divulgacion_cyt_09/Libro_Historia_Ciencia/web/CALORIMETRO%20DE%20LAVOISIER.htm
HERMES, E. (23 de DICIEMBRE de 2014). PROYECTOS DE
CIENCIAS. Obtenido de
https://feria-ciencias-elvis.blogspot.com/2014/12/calorimetro-adiabatico-casero.html?fbclid=IwAR2-JEos_X7A3r3MGHT_egiskiKiXYoiMdsHtvj7IZCLYsreT4icA7JPYmg
HERMES, H. (23 de
DICIEMBRE de 2014). PROYECTOS DE CIENCIAS.